La materia y sus estados de agregación
- Explica con tus propias palabras de forma clara el significado de las siguientes frases:
a) En las condiciones de la corteza terrestre, la materia se presenta en los tres estados más conocidos, sólido, líquido y gaseoso.
b) Los gases se caracterizan por no tener ni forma ni volumen propio.
c) Los cambios de estado son procesos reversibles.
- ¿Es lo mismo fusión que solidificación? ¿Tienen el mismo valor numérico la temperatura de fusión y la de solidificación? Pon un ejemplo que aclare la respuesta.
- La propanona, llamada vulgarmente acetona, es un líquido que se utiliza como disolvente de pinturas, lacas de uñas, etc. Si su temperatura de fusión es de −95 °C y la de ebullición de 56 °C, ¿cuál crees que sería su estado de agregación, al sol y en verano, en el punto más caliente de la Tierra? ¿Y en el más frío? Busca la información que necesites.
- Razona la veracidad de las siguientes frases:
a) Al enfriar un líquido, no siempre se produce una disminución de la temperatura.
b) La temperatura de ebullición del agua pura siempre es de 100 °C, independientemente del lugar de la Tierra donde nos encontremos.
c) La temperatura de fusión de un sólido puro es la misma que su temperatura de solidificación.
d) La temperatura de fusión del cobre es de 2 010 °F,y la del hierro de 1 538 °C; por tanto, funde antes el hierro que el plomo.
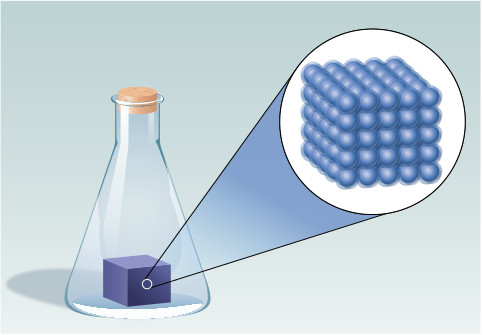
- La figura muestra uno de los estados de la materia. Razona de cuál se trata e indica sus características.
- Las temperaturas de cambios de estado de una serie de sustancias, a p = 1 atm, son:
| Sustancia |
Tfusión(°C) |
Tebullición(°C) |
| n-octano |
-57 |
126 |
| Cloruro de sodio |
801 |
1413 |
| Glicerina |
18 |
290 |
| Oxígeno |
-223 |
-183 |
a) Razona su estado de agregación si la temperatura es: a1) 25 °C; a2) 75 °C; a3) −86 °C.
b) Indica, para cada una de ellas, a qué temperatura sería siempre: b1) gas; b2) sólido.
- El nitrógeno líquido tiene numerosas aplicaciones por su capacidad para mantener a temperaturas muy bajas alimentos, muestras biológicas, etc. También se utiliza en la eliminación de verrugas y células tumorales. Su temperatura de ebullición, a p = 1 atm, es de −196 °C. Si se va a almacenar en un tanque a alta presión, razona si sería necesario mantener la temperatura por debajo de ese valor o no.

- El núcleo de la Tierra está compuesto principalmente por hierro y un pequeño porcentaje en masa, del orden del 5%, de níquel. Su temperatura alcanza los 6 700 °C, valor muy por encima de las temperaturas de ebullición de las sustancias anteriormente citadas. Entonces, ¿cómo es posible que el núcleo interno de nuestro planeta sea sólido y no gaseoso?
- El éter es una sustancia con una temperatura de ebullición normal de 34 °C:
a) ¿Por qué decimos que es un líquido volátil?
b) ¿Es correcto decir que el éter es una sustancia líquida en cualquier punto de la Tierra?
c) Razona en qué estado de agregación lo podríamos encontrar a plena luz del día en un día de: c1) verano; c2) invierno en Siberia.
La teoría cinético-molecular
- Explica brevemente las ideas fundamentales de la teoría cinético-molecular. Justifica a partir de ellas los cambios de estado.
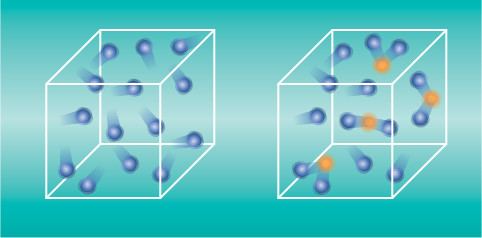
- La figura muestra cierta cantidad de gas en dos momentos diferentes. Razona en cuál de los dos casos la temperatura es mayor.
- ¿Qué sucede con la velocidad media de las partículas de un líquido cuando se eleva la temperatura?
- Justifica en cuál de las dos situaciones se seca mejor la ropa:
a)

b)

- ¿Por qué es más fácil comprimir un gas que un líquido?
- ¿Cuándo crees que las moléculas de agua tienen más energía, cerca de la temperatura de solidificación o de la de ebullición? ¿El razonamiento que has hecho sería válido para otro líquido, por ejemplo, alcohol?
 Recuerda que la energía cinética es un tipo de energía asociada al movimiento de las partículas que componen un material, por ejemplo, agua.
Recuerda que la energía cinética es un tipo de energía asociada al movimiento de las partículas que componen un material, por ejemplo, agua.
- Indica cómo explica la TCM estos hechos:
a) Al dejar en el fondo de un vaso de precipitados con agua un cristal de sulfato de cobre (II), de color azul, el agua adquiere rápidamente esta coloración.
b) Al abrir un recipiente con perfume en una habitación, al cabo de poco tiempo su olor llega a todos los lugares de dicha habitación.
c) Al bajar la temperatura, manteniendo constante la presión, el agua líquida solidifica.
d) Para vaporizar éter, un disolvente orgánico, hay que subir la temperatura.
Gráficas de cambio de estado
- a) ¿Qué es una gráfica de cambio de estado?
b) ¿Qué zonas podemos distinguir en ella?
c) ¿Qué información podemos obtener de una gráfica de cambio de estado?
- La gráfica de la figura inferior muestra la curva de calentamiento de una sustancia dada a p = 1 atm:
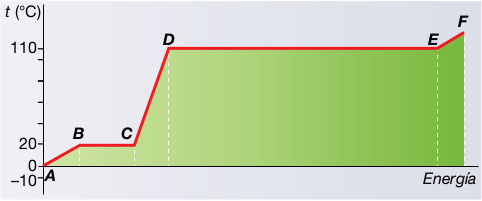
a) Indica el estado en qué se encuentra la sustancia en los tramos AB, BC, CD, DE, y EF.
b) ¿Cuál es su temperatura de fusión? ¿Y la de ebullición?
c) Recuerda las escalas de temperaturas Kelvin y Fahrenheit y expresa los valores obtenidos en el anterior apartado en dichas escalas.
d) ¿Podría corresponder esta gráfica a una sustancia como el hierro? ¿Y a un gas, como, por ejemplo, el dióxido de carbono?
- Al introducir un líquido puro a 20 °C en una nevera, se observa que durante 10 min su temperatura disminuye a razón de 2 °C/min. Después de este tiempo, se observa que la temperatura permanece constante durante 5 min, momento en el cual la temperatura comienza a bajar 5 °C/min. Representa la curva de enfriamiento del líquido citado.
Los gases y sus leyes
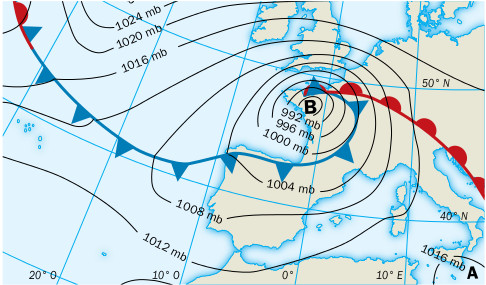
- En los mapas del tiempo, la presión se suele expresar en hectopascales, hPa, y hasta hace poco, en milibares, mb. Dibuja el mapa inferior en tu cuaderno con los valores de la presión en hPa.
- Sin necesidad de ningún cálculo matemático, razona qué le ocurrirá a:
a) La temperatura de un gas que reduce su volumen una cuarta parte, a presión constante.
b) La presión de un gas que, a volumen constante, se calienta de 20 °C a 40 °C.
c) El volumen que ocupa un gas que, a temperatura constante, reduce su presión a la mitad.
- La gráfica muestra una de las leyes de los gases. Indica de cuál se trata y explícala brevemente.
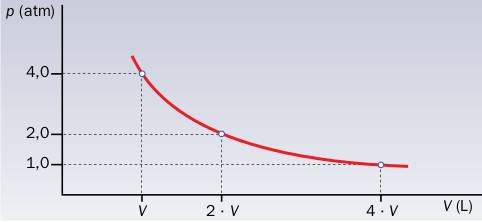
- Para cierto gas ideal se han encontrado los siguientes valores de la presión y del volumen para una misma masa de gas y a igual temperatura:
| Presión (atm) |
0,95 |
1,0 |
1,2 |
1,5 |
2,0 |
| Volumen (dm3) |
22,8 |
21,7 |
18,0 |
14,4 |
10,8 |
Razona si se cumple la ley de Boyle. En caso afirmativo, ¿qué presión habría que ejercer sobre el gas para que su volumen fuese de 20 dm3? Resuelve esta cuestión a partir de la gráfica p-V.
Solución: p = 1,1 atm.
- Dos recipientes contienen la misma masa de gas. En el primero la presión es de 0,75 atm, y en el segundo, de 990 mb. ¿En cuál de los dos es mayor la presión?
Solución: En el segundo.
- Completa los valores que faltan:
- Siguiendo las normas elementales de seguridad, un conductor revisa la presión de los neumáticos de su vehículo antes de iniciar un viaje. Al cabo de cierto tiempo para a descansar y mide de nuevo la presión, observando que esta ha aumentado:
a) ¿Debe preocuparse por este hecho o es lógico lo que ha ocurrido?
b) ¿Qué observaría si vuelve a medir la presión al cabo de una hora?
- Una bombona que contiene cierto gas tiene un volumen de 50 dm3. A 25 °C, la presión que soportan las paredes de la bombona es de 2,9 atm. ¿Qué presión ejercerá el gas si se duplica la temperatura?
Solución: p2 = 3,1 atm.
- Veinticinco litros de aire a 298 K se enfrían hasta 32 °F. Calcula el volumen que ocupará el aire, suponiendo que la presión se mantiene constante.
Solución: V2 = 23 L.
- Completa la tabla . Supón que se cumple la primera ley de Charles y Gay-Lussac:
Ahora resuelve las siguientes cuestiones:
a) ¿Qué tipo de gráfica se obtiene al representar V frente a T?
b) ¿Cómo calcularías a partir de la gráfica el volumen que ocupa el gas si la temperatura es de −5 °C?
- Un grupo de científicos ha estudiado cómo varía el volumen de cierto gas con la temperatura, manteniendo constante la presión. Han realizado catorce experiencias y las parejas de valores V-t los han representado, obteniendo la siguiente gráfica.
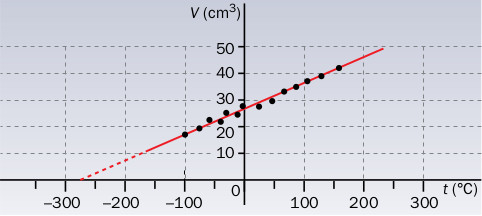
a) ¿Se ajusta a una de las leyes de los gases? ¿A cuál?
b) A continuación deciden volver a representar los valores obtenidos, pero expresando ahora la temperatura en la escala absoluta y el volumen en litros. ¿Volverían a obtener una línea recta?
- Un grupo de alumnos estudia el comportamiento de un gas al calentarlo a p = cte, observando que su volumen aumenta linealmente con la temperatura. Para explicarlo, elaboran la siguiente hipótesis: «El volumen del gas aumenta porque aumenta el volumen de las partículas que lo componen»
¿Estás de acuerdo, o no, con su hipótesis?
- Determina la altura de una montaña, sobre el nivel del mar, en la que el barómetro marca 730 mmHg a 375 m de altura y 520 mmHg en la cima.
 Recuerda que la presión atmosférica disminuye con la altitud. Para altitudes pequeñas, no mayores de 1 km, esta disminución es lineal, pudiendo suponer que por cada 10 mque nos elevemos, la presión disminuya 1 mmHg.
Recuerda que la presión atmosférica disminuye con la altitud. Para altitudes pequeñas, no mayores de 1 km, esta disminución es lineal, pudiendo suponer que por cada 10 mque nos elevemos, la presión disminuya 1 mmHg.
Solución: h = 2475 m.
- En cierta industria de producción de ácido sulfúrico, H2SO4, necesitan 1 000 m3 de oxígeno, O2. Calcula:
a) El volumen de aire necesario.
b) Si la densidad de este gas, a p = 1 atm y temperatura de 0 °C, es de 1,429 kg/m3, ¿a qué masa equivale dicho volumen de oxígeno?
c) Si la temperatura a la que se encuentra el oxígeno fuese mayor, por ejemplo, 50 °C, su densidad, ¿valdría lo mismo? ¿Sería mayor, menor?
Solución: a) Vaire = 4 774 m3. b) mO2 = 1 429 kg.
 Encontrarás una autoevaluación interactiva.
Encontrarás una autoevaluación interactiva.
